பெரிலியம் சல்பேட்டு
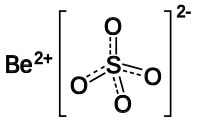
பெரிலியம் சல்பேட்டு (Beryllium sulfate) என்பது பொதுவாக நான்கு நீரேற்றாகவே காணப்படுகிறது எனவே இதனுடைய மூலக்கூற்று வாய்ப்பாடு BeSO4•4H2O என்றே எழுதப்படுகிறது. முதன்முதலில் 1815 ஆம் ஆண்டில் யோன்சு யோக்காப் பெர்சிலியசு பெரிலியம் சல்பேட்டைத் தனிமைப்படுத்தினார்.[3]
| |

| |
| இனங்காட்டிகள் | |
|---|---|
| 13510-49-1 7787-56-6 (tetrahydrate) | |
| ChEBI | CHEBI:53473 |
| ChemSpider | 24291 |
| EC number | 236-842-2 |
| யேமல் -3D படிமங்கள் | Image |
| பப்கெம் | 26077 |
| வே.ந.வி.ப எண் | DS4800000 |
| |
| பண்புகள் | |
| BeSO4 | |
| வாய்ப்பாட்டு எடை | 105.075 கி/மோல் (நீரிலி) 177.136 கி/மோல் (நான்கு நீரேற்று) |
| தோற்றம் | வெண் திண்மம் |
| மணம் | நெடியற்றது |
| அடர்த்தி | 2.44 கி/செ.மீ3 (நீரிலி) 1.71 கி/செ.மீ3 (நான்கு நீரேற்று) |
| உருகுநிலை | 110 °C (230 °F; 383 K) (நான்கு நீரேற்று, −2H2O) 400 °செ (இரு நீரேற்று, dehydr.) 550–600 சிதைவடைகிறது |
| கொதிநிலை | 2,500 °C (4,530 °F; 2,770 K) (நீரிலி) 580 °செ (நான்கு நீரேற்று) |
| 36.2 கி/100 மி.லி (0 °செ) 40.0 கி/100 மி.லி (20 °செ) 54.3 கி/100 மி.லி (60 °செ) | |
| கரைதிறன் | ஆல்ககாலில் கரையாது |
| ஒளிவிலகல் சுட்டெண் (nD) | 1.4374 (நான்கு நீரேற்று) |
| வெப்பவேதியியல் | |
| Std enthalpy of formation ΔfH |
-1197 கியூ/மோல் |
| நியம மோலார் எந்திரோப்பி S |
90 யூ/மோல் கெ |
| தீங்குகள் | |
| பொருள் பாதுகாப்பு குறிப்பு தாள் | ICSC 1351 |
| GHS pictograms |   
|
| GHS signal word | DANGER |
| H350, H330, H301, H372, H319, H335, H315, H317, H411 | |
| ஈயூ வகைப்பாடு | புற்றுநோய் வகை. 2 அதிக நச்சு (T+) சுற்றுச் சூழலுக்கு அபாயமானது (N) |
| S-சொற்றொடர்கள் | S53, S45 |
| தீப்பற்றும் வெப்பநிலை | எளிதில் தீப்பற்றாது |
| Lethal dose or concentration (LD, LC): | |
LD50 (Median dose)
|
82 மி.கி/கி.கி (எலி, வாய்வழி) 80 மி.கி/கி.கி (சுண்டெலி, வாய்வழி)[2] |
| அமெரிக்க சுகாதார ஏற்பு வரம்புகள்: | |
அனுமதிக்கத்தக்க வரம்பு
|
TWA 0.002 மி.கி/மீ3 C 0.005 மி.கி/மீ3 (30 நிமிடங்கள்), அதிகபட்ச உச்சம் 0.025 மி.கி/மீ3 (as Be)[1] |
பரிந்துரைக்கப்பட்ட வரம்பு
|
Ca C 0.0005 mg/m3 (as Be)[1] |
உடனடி அபாயம்
|
Ca [4 மி.கி/மீ3 (as Be)][1] |
| தொடர்புடைய சேர்மங்கள் | |
| ஏனைய நேர் மின்அயனிகள் | மக்னீசியம் சல்பேட்டு கால்சியம் சல்பேட்டு இசுட்ரோன்சியம் சல்பேட்டு பேரியம் சல்பேட்டு |
மாறுதலாக ஏதும் சொல்லவில்லை என்றால் கொடுக்கப்பட்ட தரவுகள் யாவும் பொருள்கள் அவைகளின் இயல்பான வெப்ப அழுத்த நிலையில் (25°C, 100kPa) இருக்கும். | |
பெரிலியம் உப்பின் நீர்க்கரைசலுடன் கந்தக அமிலம் சேர்த்து தொடர்ந்து ஆவியாக்கி படிகமாக்குவதன் மூலம் பெரிலியம் சல்பேட்டைத் தயாரிக்கலாம். நீரேற்று வடிவ பெரிலியம் சல்பேட்டை 400 0 செல்சியசு வெப்பநிலைக்கு சூடாக்குவதன் மூலம் நீரிலி உப்பைத் தயாரிக்க முடியும்[4]. இந்நான்கு நீரேற்றில் நான்முக Be(OH2)42+ அலகுகள் மற்றும் சல்பேட்டு எதிர்மின் அயனிகள் காணப்படுகின்றன. Be2+ [[அயனி|நேர்மின் அயனிகளின்] சிறிய அளவானது ஒருங்கிணைப்புக்குத் தேவையான நீர் மூலக்கூறுகளின் எண்ணிக்கையை உறுதிப்படுத்துகிறது. இதனை ஒத்த வரிசைச் சேர்மமான எண்முக Mg(OH2)62+ அலகுகள் கொண்ட மக்னீசியம் உப்பிலிருந்து பெரிலியம் சல்பேட்டு மாறுபடுகிறது.[5]
பெரிலியம் சல்பேட்டின் நீரிலி வடிவச் சேர்மம் பெர்லினைட்டு கனிமத்தின் படிக அமைப்பை ஒத்துள்ளது. இவ்வமைப்பில் ஒன்றுவிட்டு ஒன்றாக Be மற்றும் S அணுக்கள் நான்முக ஒருங்கிணைப்பு முறைமையிலும் ஒவ்வொரு ஆக்சிசனும் இரண்டு (Be-O-S) ஒருங்கிணைப்புகளையும் கொண்டிருக்கின்றன. Be-O பிணைப்புகளுக்கு இடையிலான பிணைப்பு நீளம் 156 பைகோ மீட்டர்களாகவும் S-O பிணைப்புகளின் பிணைப்பு நீளம் 150 பைகோ மீட்டர்களாகவும் உள்ளது.[6]
அணுக்கரு பிளவு கண்டறியப்பட்டதில் பெரிலியம் சல்பேட்டு மற்றும் ரேடியம் சல்பேட்டுகளின் கலவை நியூட்ரான் மூலமாகப் பயன்படுத்தப்பட்டது.
மேற்கோள்கள்
தொகு- ↑ 1.0 1.1 1.2 "NIOSH Pocket Guide to Chemical Hazards #0054". National Institute for Occupational Safety and Health (NIOSH).
- ↑ "Beryllium compounds (as Be)". Immediately Dangerous to Life and Health. National Institute for Occupational Safety and Health (NIOSH).
- ↑ Lathrop Parsons, Charles (1909), The Chemistry and Literature of Beryllium, London, pp. 29–33
{{citation}}: CS1 maint: location missing publisher (link). - ↑ Patnaik, Pradyot (2002), Handbook of Inorganic Chemicals, McGraw-Hill, பன்னாட்டுத் தரப்புத்தக எண் 0-07-049439-8.
- ↑ Wells A.F. (1984) Structural Inorganic Chemistry 5th edition Oxford Science Publications பன்னாட்டுத் தரப்புத்தக எண் 0-19-855370-6
- ↑ Grund, Alfred (1955). "Die Kristallstruktur von BeSO4". Tschermaks Mineralogische und Petrographische Mitteilungen 5 (3): 227–230. doi:10.1007/BF01191066. பன்னாட்டுத் தர தொடர் எண்:0041-3763.