இசுக்காண்டியம்
இசுக்காண்டியம் (ஆங்கிலம்:Scandium) என்பது இசுக்காண்டினேவியாவில் கிடைக்கும் சில கனிமங்களில் இருந்து பிரிதெடுக்கப்படும் வெள்ளி போன்ற வெண்மையான நிறமுடைய திண்மநிலையில் இருக்கும் மாழைப் பண்புள்ள தனிமம். இது Sc என்னும் அணுக் குறியெழுத்து கொண்டது இதன் அணுவெண் 21. இது லாந்த்தனைடுகள், ஆக்டினைடுகள், மற்றும் இயிற்றியம் போன்று நில உலகில் கனிமங்களில் இருந்து அரிதாகக் கிடைக்கும் ஒரு தனிமமாகும்.[3][4][5] ஸ்காண்டியம் பூமியில் மிகக் குறைவாகவே செழுமையுற்றிருந்தாலும் சூரியனிலும் ஒரு சில விண்மீன்களிலும் ஓரளவு செழிப்புற்றிருக்கின்றது. செழுமை வரிசையில் ஸ்காண்டியம் சூரியனில் 23 ஆவதாகவும் பூமியில் 50 ஆவதாகவும் உள்ளது.[6] இது பூமியின் மேலோட்டுப் பகுதியில் எங்கும் பரவலாகக் காணப்படுகின்றது.
| ஸ்காண்டியம் | ||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
21Sc
| ||||||||||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||||||||||||||
| தோற்றம் | ||||||||||||||||||||||||||||||||||||||||||||||||||||
வெள்ளிபோல் வெண்மை
| ||||||||||||||||||||||||||||||||||||||||||||||||||||
| பொதுப் பண்புகள் | ||||||||||||||||||||||||||||||||||||||||||||||||||||
| பெயர், குறியீடு, எண் | ஸ்காண்டியம், Sc, 21 | |||||||||||||||||||||||||||||||||||||||||||||||||||
| உச்சரிப்பு | /ˈskændiəm/ SKAN-dee-əm | |||||||||||||||||||||||||||||||||||||||||||||||||||
| தனிம வகை | தாண்டல் உலோகங்கள் | |||||||||||||||||||||||||||||||||||||||||||||||||||
| நெடுங்குழு, கிடை வரிசை, குழு | 3, 4, d | |||||||||||||||||||||||||||||||||||||||||||||||||||
| நியம அணு நிறை (அணுத்திணிவு) |
44.955912(6) | |||||||||||||||||||||||||||||||||||||||||||||||||||
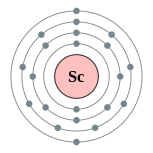
| இலத்திரன் அமைப்பு | [Ar] 3d1 4s2 2, 8, 9, 2 | |||||||||||||||||||||||||||||||||||||||||||||||||||
| இயற்பியற் பண்புகள் | ||||||||||||||||||||||||||||||||||||||||||||||||||||
| நிலை | திண்மம் | |||||||||||||||||||||||||||||||||||||||||||||||||||
| அடர்த்தி (அ.வெ.நிக்கு அருகில்) | 2.985 g·cm−3 | |||||||||||||||||||||||||||||||||||||||||||||||||||
| திரவத்தின் அடர்த்தி உ.நி.யில் | 2.80 g·cm−3 | |||||||||||||||||||||||||||||||||||||||||||||||||||
| உருகுநிலை | 1814 K, 1541 °C, 2806 °F | |||||||||||||||||||||||||||||||||||||||||||||||||||
| கொதிநிலை | 3109 K, 2836 °C, 5136 °F | |||||||||||||||||||||||||||||||||||||||||||||||||||
| உருகலின் வெப்ப ஆற்றல் | 14.1 கி.யூல்·மோல்−1 | |||||||||||||||||||||||||||||||||||||||||||||||||||
| வளிமமாக்கலின் வெப்ப ஆற்றல் | 332.7 கி.யூல்·மோல்−1 | |||||||||||||||||||||||||||||||||||||||||||||||||||
| வெப்பக் கொண்மை | 25.52 யூல்.மோல்−1·K−1 | |||||||||||||||||||||||||||||||||||||||||||||||||||
| ஆவி அழுத்தம் | ||||||||||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||||||||||||||
| அணுப் பண்புகள் | ||||||||||||||||||||||||||||||||||||||||||||||||||||
| ஒக்சியேற்ற நிலைகள் | 3, 2[1], 1[2] (ஈரியல்பு ஒக்சைட்டு) | |||||||||||||||||||||||||||||||||||||||||||||||||||
| மின்னெதிர்த்தன்மை | 1.36 (பாலிங் அளவையில்) | |||||||||||||||||||||||||||||||||||||||||||||||||||
| மின்மமாக்கும் ஆற்றல் (மேலும்) |
1வது: 633.1 kJ·mol−1 | |||||||||||||||||||||||||||||||||||||||||||||||||||
| 2வது: 1235.0 kJ·mol−1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||
| 3வது: 2388.6 kJ·mol−1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||
| அணு ஆரம் | 162 பிமீ | |||||||||||||||||||||||||||||||||||||||||||||||||||
| பங்கீட்டு ஆரை | 170±7 pm | |||||||||||||||||||||||||||||||||||||||||||||||||||
| வான்டர் வாலின் ஆரை | 211 பிமீ | |||||||||||||||||||||||||||||||||||||||||||||||||||
| பிற பண்புகள் | ||||||||||||||||||||||||||||||||||||||||||||||||||||
| படிக அமைப்பு | hexagonal | |||||||||||||||||||||||||||||||||||||||||||||||||||
| காந்த சீரமைவு | paramagnetic | |||||||||||||||||||||||||||||||||||||||||||||||||||
| மின்கடத்துதிறன் | (அ.வெ.) (α, பல்படிக) கணிப்பு. 562 nΩ·m | |||||||||||||||||||||||||||||||||||||||||||||||||||
| வெப்ப கடத்துத் திறன் | 15.8 W·m−1·K−1 | |||||||||||||||||||||||||||||||||||||||||||||||||||
| வெப்ப விரிவு | (அ.வெ.) (α, பல்படிக) 10.2 µm/(m·K) | |||||||||||||||||||||||||||||||||||||||||||||||||||
| யங் தகைமை | 74.4 GPa | |||||||||||||||||||||||||||||||||||||||||||||||||||
| நழுவு தகைமை | 29.1 GPa | |||||||||||||||||||||||||||||||||||||||||||||||||||
| பரும தகைமை | 56.6 GPa | |||||||||||||||||||||||||||||||||||||||||||||||||||
| பாய்சான் விகிதம் | 0.279 | |||||||||||||||||||||||||||||||||||||||||||||||||||
| பிரிநெல் கெட்டிமை | 750 MPa | |||||||||||||||||||||||||||||||||||||||||||||||||||
| CAS எண் | 7440-20-2 | |||||||||||||||||||||||||||||||||||||||||||||||||||
| மிக உறுதியான ஓரிடத்தான்கள் (சமதானிகள்) | ||||||||||||||||||||||||||||||||||||||||||||||||||||
| முதன்மைக் கட்டுரை: ஸ்காண்டியம் இன் ஓரிடத்தான் | ||||||||||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||||||||||||||
வரலாறு
தொகுமென்டலீவ் என்பவர் தனிம அட்டவனையை நிறுவும் போது போரான் தொகுதியில் ஒரு நிரப்பப்படாத கட்டத்தில் இருக்க வேண்டிய இன்னும் கண்டுபிடிக்கப்படாத தனிமத்தின் பெயரை 'ஏக போரான்' என்றும் அதன் அணு நிறை கால்சியம் 40 க்கும் டைட்டானியம் 48 க்கும் இடைப்பட்டதாக இருக்கும் என 1869 இல் முன்கூட்டியே அறிவித்தார். 1876 ல் ஸ்வீடன் நாட்டு வேதியலாளரான பிரெடரிக் நில்சன் (Lars Fredrik Nilson]) என்பார் ஸ்காண்டிநேவியா என்ற பகுதியில் கிடைக்கும் கடோலினைட் போன்ற சில குறிப்பிட்ட கனிமங்களிலிருந்து ஸ்காண்டியத்தைக் கண்டுபிடித்தார்.[7][8] எனினும் நெல்சனின் பல ஆய்வு முடிவுகள் பிழையாக இருந்தன. மூன்று பிணைதிறன் (Valency ) கொண்ட ஸ்காண்டியத்திற்கு பிணைதிறன் 4 என்று மதிப்பிட்டு அதன் ஆக்சைடை ScO2 என்று தவறாகக் குறிப்பிட்டார். இதன் அணு நிறையைச் சரியாக மதிப்பிடாமல் 160 -180 க்குள் இருக்கும் என நெடுக்கை அளவில் குறிப்பிட்டிருந்தார். மேலும் இது டின்னுக்கும், தோரியத்திற்கும் இடைப்பட்டது என்று அறிவித்தார். இதன் பிறகு அதே நாட்டைச் சேர்ந்த கிளிவ் (P.Cleve) என்ற விஞ்ஞானி இதை முழுமையாக ஆராய்ந்து அதன் ஆக்சைடு Sc2O3 என்று கண்டுபிடித்ததோடு அது மென்டலீவ் தெரிவித்த ஏக போரான் என்றும் தெளிவு படுத்தினார்.[9] இதனால் இந்த உலோகத்தின் கண்டுபிடிப்பில் இவருடைய பெயரும் இணைந்தது.
உலோக நிலையில் தூய ஸ்காண்டியத்தை 1937 ல் பிஷர், பிருங்கர், கிரினெய்சென் (Fischer, Brunger and Grieneisen) போன்ற விஞ்ஞானிகள் ஸ்காண்டியம் குளோரைடுடன் 700 -800 °C வெப்ப நிலையில் பொட்டாசியம் ,லித்தியம் இவற்றைக் கலந்து உருக்கி மின்னாற் பகுப்பு மூலம் உற்பத்தி செய்தனர்.[10] டங்ஸ்டன் கம்பியும் உருகிய துத்தநாகக் குழம்பும் கிராபைட் குப்பியில் மின்வாய்களாகப் பயன்படுத்தப்பட்டன.
பண்புகள்
தொகுதூய புதிய இசுக்காண்டியம் வெள்ளி போன்ற வெண்ணிறப் பளபளப்புக் கொண்டது.இது மென்மையான எடை குறைந்த திண்ம நிலையில் உள்ள மாழை. காற்று படும் இடத்தில் இருந்தால் சிறிதளவு மஞ்சள் நிறம் அல்லது வெளிறிய இளஞ்சிவப்பு நிறம் பெறுகின்றது. அருமன் உலோகங்களைப் போலவும், எட்ரியம் போலவும் இன்னும் அதிகமாக அலுமினியம் அல்லது டைட்டானியம் போலவும் இருக்கிறது.[11] இது லேசான உலோகமாக இருப்பினும் அலுமினியத்தை விட அதிக உருகு நிலையைப் பெற்றிருக்கிறது ஸ்காண்டியத்தின் அணு எண் 21 ,அணு எ டை 44.96 .இதன் உருகு நிலையும், கொதி நிலையும் முறையே 1812 K,3000 K உள்ளது; அடர்த்தி 3000 கிகி /கமீ. 1:1 (ஒன்றுக்கு ஒன்று என்னும் விகிதத்தில்) சேர்ந்த கடும் காடிக் கலவையாகிய நைட்ரிக் காடியும் (HNO3) ஐதரோ-புளோரிக் காடியும் H,F இந்த இசுக்காண்டியத்தைத் தாக்குவதில்லை.
பயன்கள்
தொகுஇசுக்காண்டியமும் அலுமினியமும் சேர்ந்த உலோகக் கலவை சில விளையாட்டுக் கருவிகள் மற்றும் மிதிவண்டிகளின் பாகங்கள் செய்யப் பயன்படுகிறது.[12][13] இசுக்காண்டியம் அலுமினியம் அல்லது டைட்டானியம் போல பயன்மிக்கது.[14] இது விண்கலங்களின் கட்டமைப்பு, விண்வெளி ஆய்கருவிகளில் பயன்படுகிறது.[11] இசுக்காண்டியம், 1 :1 விகிதத்தில் கலப்புள்ள அடர் நைட்ரிக் அமிலம் மற்றும் 48விழுக்காடு ஹைட்ரஜன் புளூரைடு கரைசலால் பாதிக்கப்படுவதில்லை. இசுக்காண்டியத்தில் உள்ள டான்டலத்தைக் கரைப்பதற்கு இக்கரைசல் பயன்தருகிறது.
பல்மருத்துவத்தில் ஸ்காண்டிய ஒளிக்கற்றைப் பயன்படுத்தப்படுகிறது.[15] பாதரச ஆவி விளக்குகளில் பயன்படுத்தப்படும் இசுக்காண்டிய அயோடைடு மற்றும் சோடியம் அயோடைடு இணைந்த கலவை வேறொரு மாற்று விகிதத்தில் சேர்க்கப்பட்டு அவை உலோக ஹாலைடு விளக்குகளில் பயன்படுத்தப்படுகின்றன. இது தொலைக்காட்சிப் படஒளிப்பதிவுக்கருவிகளில் சூரிய ஒளி போன்ற ஒரு வெள்ளொளி மூலத்தைச் சேர்க்க உதவுகிறது.[16]
46Sc என்ற கதிரியக்க ஓரிடத்தான்கள் எண்ணெய் சுத்திகரிப்பு ஆலைகளில் பயன்படுத்தப்படுகின்றன.[17] பெர்லியம் சிலிகேட் என்ற பெரைலில் சிறப்பு நிறமூட்ட இசுக்காண்டியம் பயன்படுகிறது. பெரைலினின் நீல நிறத்திற்கு ஸ்காண்டியம் காரணமாக இருக்கிறது.
இவற்றையும் பார்க்க
தொகு- வாயுஏற்பி புரதம்.
மேற்கோள்களும் குறிப்புகளும்
தொகு- ↑ McGuire, Joseph C.; Kempter, Charles P. (1960). "Preparation and Properties of Scandium Dihydride". Journal of Chemical Physics 33: 1584–1585. doi:10.1063/1.1731452. Bibcode: 1960JChPh..33.1584M.
- ↑ Smith, R. E. (1973). "Diatomic Hydride and Deuteride Spectra of the Second Row Transition Metals". Proceedings of the Royal Society of London. Series A, Mathematical and Physical Sciences 332 (1588): 113–127. doi:10.1098/rspa.1973.0015. Bibcode: 1973RSPSA.332..113S.
- ↑ Kristiansen, Roy (2003). "Scandium – Mineraler I Norge" (in Norwegian). Stein: 14–23 இம் மூலத்தில் இருந்து 2010-10-08 அன்று. பரணிடப்பட்டது.. https://web.archive.org/web/20101008054147/http://www.nags.net/Stein/2003/Sc-minerals.pdf. பார்த்த நாள்: 2012-10-24.
- ↑ von Knorring, O.; Condliffe, E. (1987). "Mineralized pegmatites in Africa". Geological Journal 22: 253. doi:10.1002/gj.3350220619.
- ↑ Bernhard, F. (2001). "Scandium mineralization associated with hydrothermal lazurite-quartz veins in the Lower Austroalpie Grobgneis complex, East Alps, Austria". Mineral Deposits in the Beginning of the 21st Century. Lisse: Balkema. பன்னாட்டுத் தரப்புத்தக எண் 90-265-1846-3.
- ↑ Lide, David R. (2004). CRC Handbook of Chemistry and Physics. Boca Raton: CRC Press. pp. 4–28. பன்னாட்டுத் தரப்புத்தக எண் 978-0-8493-0485-9.
- ↑ Nilson, Lars Fredrik (1879). "Sur l'ytterbine, terre nouvelle de M. Marignac" (in French). Comptes Rendus 88: 642–647. http://gallica.bnf.fr/ark:/12148/bpt6k30457/f639.table.
- ↑ Nilson, Lars Fredrik (1879). "Ueber Scandium, ein neues Erdmetall" (in German). Berichte der deutschen chemischen Gesellschaft 12 (1): 554–557. doi:10.1002/cber.187901201157.
- ↑ Cleve, Per Teodor (1879). "Sur le scandium" (in French). Comptes Rendus 89: 419–422. http://gallica.bnf.fr/ark:/12148/bpt6k3046j/f432.table.
- ↑ Fischer, Werner; Brünger, Karl; Grieneisen, Hans (1937). "Über das metallische Scandium" (in German). Zeitschrift für anorganische und allgemeine Chemie 231 (1–2): 54–62. doi:10.1002/zaac.19372310107.
- ↑ 11.0 11.1 11.2 Ahmad, Zaki (2003). "The properties and application of scandium-reinforced aluminum". JOM 55 (2): 35. doi:10.1007/s11837-003-0224-6. Bibcode: 2003JOM....55b..35A.
- ↑ Bjerklie, Steve (2006). "A batty business: Anodized metal bats have revolutionized baseball. But are finishers losing the sweet spot?". Metal Finishing 104 (4): 61. doi:10.1016/S0026-0576(06)80099-1. https://archive.org/details/sim_metal-finishing_2006-04_104_4/page/61.
- ↑ "Easton Technology Report : Materials / Scandium" (PDF). EastonBike.com. Archived (PDF) from the original on 2008-11-14. பார்க்கப்பட்ட நாள் 2009-04-03.
- ↑ Schwarz, James A.; Contescu, Cristian I.; Putyera, Karol (2004). Dekker encyclopédia of nanoscience and nanotechnology, Volume 3. CRC Press. p. 2274. பன்னாட்டுத் தரப்புத்தக எண் 0-8247-5049-7.
{{cite book}}: CS1 maint: multiple names: authors list (link) - ↑ Nouri, Keyvan (2011-11-09). "History of Laser Dentistry". Lasers in Dermatology and Medicine. pp. 464–465. பன்னாட்டுத் தரப்புத்தக எண் 978-0-85729-280-3.
- ↑ Simpson, Robert S. (2003). Lighting Control: Technology and Applications. Focal Press. p. 108. பன்னாட்டுத் தரப்புத்தக எண் 978-0-240-51566-3.
- ↑ Hammond, C.R. in CRC Handbook of Chemistry and Physics 85th ed., Section 4; The Elements
உசாத்துணை
தொகு- Eric Scerri, The Periodic System, Its Story and Its Significance, Oxford University Press, New York, 2007.
வெளியிணைப்புகள்
தொகு- Scandium at The Periodic Table of Videos (University of Nottingham)
- WebElements.com – Scandium
- "Scandium". பிரித்தானிக்கா கலைக்களஞ்சியம் (11th). (1911).