சிலிக்கான்
சிலிக்கான் அல்லது மண்ணியம் (இலங்கை வழக்கு: சிலிக்கன்; ஆங்கிலம்: Silicon) ஒரு தனிமம் ஆகும். இதன் குறியீடு Si. அணு எண் 14. இது அண்டத்தில் மிகுந்து காணப்படும் தனிமம் ஆகும். புவி ஓட்டில் ஆக்ஸிஜனுக்கு அடுத்து அதிகம் கிடைப்பது சிலிக்கான் ஆகும். இது தூய தனிமமாக அரிதாகவே கிடைக்கிறது. சிலிக்கான் ஒரு அலோகம். பூமியின் புறவோட்டுப் பகுதியில் 28 விழுக்காடு இருப்பினும் இது காலங்கடந்தே கண்டறியப்பட்டது.[7] இதற்குக் காரணம் அதன் ஆக்சைடிலிருந்து ஆக்சிஜனை நீக்கம் செய்து சிலிகானைத் தனித்துப் பிரிப்பதில் உள்ள இடர்பாடுகளே ஆகும். சிலிகான் இயற்கையில் தனித்துக் காணப்படவில்லை. ஆக்சைடாகவும், சிலிகேட்டாகவும் உள்ளது. மணல், குவார்ட்ஸ் பாறைப் படிகங்கள்,[8] அகேட் மற்றும் சில வகையான இரத்தினக் கற்களில் ஆக்சைடாகவும், கிரானைட், அஸ்பெஸ்டோஸ், களிமண், மைக்கா போன்றவற்றில் சிலிகேட்டாகவும் சிலிகான் உள்ளது. ஆக்சிஜனுக்கு அடுத்தபடியாக பூமியில் அதிகமாகச் செழுமையுற்றிருக்கும் தனிமம் சிலிகான் ஆகும்.[9]
| சிலிக்கான் | |||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
14Si
| |||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||
| தோற்றம் | |||||||||||||||||||||||||||||||
| பளிங்குரு, சற்றே நீல நிறம் காட்டுவதாக எதிரொளிக்கும் சிலிக்கனின் நிறமாலைக்கோடுகள் | |||||||||||||||||||||||||||||||
| பொதுப் பண்புகள் | |||||||||||||||||||||||||||||||
| பெயர், குறியீடு, எண் | சிலிக்கான், Si, 14 | ||||||||||||||||||||||||||||||
| உச்சரிப்பு | /ˈsɪl[invalid input: 'ɨ']kən/ SIL-ə-kən or /ˈsɪl[invalid input: 'ɨ']kɒn/ SIL-ə-kon | ||||||||||||||||||||||||||||||
| தனிம வகை | உலோகப்போலி | ||||||||||||||||||||||||||||||
| நெடுங்குழு, கிடை வரிசை, குழு | 14, 3, p | ||||||||||||||||||||||||||||||
| நியம அணு நிறை (அணுத்திணிவு) |
28.0855(3) | ||||||||||||||||||||||||||||||
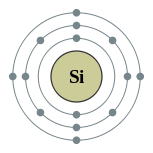
| இலத்திரன் அமைப்பு | [Ne] 3s2 3p2 2, 8, 4 | ||||||||||||||||||||||||||||||
| வரலாறு | |||||||||||||||||||||||||||||||
| முன்னூகிப்பு | A. Lavoisier (1787) | ||||||||||||||||||||||||||||||
| கண்டுபிடிப்பு | J. Berzelius[1][2] (1824) | ||||||||||||||||||||||||||||||
| முதற்தடவையாகத் தனிமைப்படுத்தியவர் |
J. Berzelius (1824) | ||||||||||||||||||||||||||||||
| பெயரிட்டவர் | T. Thomson (1831) | ||||||||||||||||||||||||||||||
| இயற்பியற் பண்புகள் | |||||||||||||||||||||||||||||||
| நிலை | திண்மம் | ||||||||||||||||||||||||||||||
| அடர்த்தி (அ.வெ.நிக்கு அருகில்) | 2.3290 g·cm−3 | ||||||||||||||||||||||||||||||
| திரவத்தின் அடர்த்தி உ.நி.யில் | 2.57 g·cm−3 | ||||||||||||||||||||||||||||||
| உருகுநிலை | 1687 K, 1414 °C, 2577 °F | ||||||||||||||||||||||||||||||
| கொதிநிலை | 3538 K, 3265 °C, 5909 °F | ||||||||||||||||||||||||||||||
| உருகலின் வெப்ப ஆற்றல் | 50.21 கி.யூல்·மோல்−1 | ||||||||||||||||||||||||||||||
| வளிமமாக்கலின் வெப்ப ஆற்றல் | 359 கி.யூல்·மோல்−1 | ||||||||||||||||||||||||||||||
| வெப்பக் கொண்மை | 19.789 யூல்.மோல்−1·K−1 | ||||||||||||||||||||||||||||||
| ஆவி அழுத்தம் | |||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||
| அணுப் பண்புகள் | |||||||||||||||||||||||||||||||
| ஒக்சியேற்ற நிலைகள் | 4, 3, 2, 1[3] -1, -2, -3, -4 (ஈரியல்பு ஒக்சைட்டு) | ||||||||||||||||||||||||||||||
| மின்னெதிர்த்தன்மை | 1.90 (பாலிங் அளவையில்) | ||||||||||||||||||||||||||||||
| மின்மமாக்கும் ஆற்றல் (மேலும்) |
1வது: 786.5 kJ·mol−1 | ||||||||||||||||||||||||||||||
| 2வது: 1577.1 kJ·mol−1 | |||||||||||||||||||||||||||||||
| 3வது: 3231.6 kJ·mol−1 | |||||||||||||||||||||||||||||||
| அணு ஆரம் | 111 பிமீ | ||||||||||||||||||||||||||||||
| பங்கீட்டு ஆரை | 111 pm | ||||||||||||||||||||||||||||||
| வான்டர் வாலின் ஆரை | 210 பிமீ | ||||||||||||||||||||||||||||||
| பிற பண்புகள் | |||||||||||||||||||||||||||||||
| படிக அமைப்பு | diamond cubic | ||||||||||||||||||||||||||||||
| காந்த சீரமைவு | diamagnetic[4] | ||||||||||||||||||||||||||||||
| மின்கடத்துதிறன் | (20 °C) 103[5]Ω·m | ||||||||||||||||||||||||||||||
| வெப்ப கடத்துத் திறன் | 149 W·m−1·K−1 | ||||||||||||||||||||||||||||||
| வெப்ப விரிவு | (25 °C) 2.6 µm·m−1·K−1 | ||||||||||||||||||||||||||||||
| ஒலியின் வேகம் (மெல்லிய கம்பி) | (20 °C) 8433 மீ.செ−1 | ||||||||||||||||||||||||||||||
| யங் தகைமை | 130-188[6] GPa | ||||||||||||||||||||||||||||||
| நழுவு தகைமை | 51-80[6] GPa | ||||||||||||||||||||||||||||||
| பரும தகைமை | 97.6[6] GPa | ||||||||||||||||||||||||||||||
| பாய்சான் விகிதம் | 0.064 - 0.28[6] | ||||||||||||||||||||||||||||||
| மோவின் கெட்டிமை (Mohs hardness) |
7 | ||||||||||||||||||||||||||||||
| CAS எண் | 7440-21-3 | ||||||||||||||||||||||||||||||
| பட்டை இடைவெளி ஆற்றல் 300 K இல் | 1.12 eV | ||||||||||||||||||||||||||||||
| மிக உறுதியான ஓரிடத்தான்கள் (சமதானிகள்) | |||||||||||||||||||||||||||||||
| முதன்மைக் கட்டுரை: சிலிக்கான் இன் ஓரிடத்தான் | |||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||
வரலாறு
தொகுமண்ணியத்தை ஒரு வேதித் தனிமமாக அறிவதற்கு முன்பே அதன் சேர்மங்களைப் பற்றி பழங்காலத்திலிருந்தே தெரிந்து வைத்திருந்தார்கள். கண்ணாடி என்பது சிலிகேட்டாகும்.இதை வெகு காலமாக மக்கள் கண்ணாடியாலான பொருட்கள் செய்வதற்கும், கட்டடங்களின் அழகை மேம்படுத்துவதற்கான கட்டுமானப் பொருளாக்கப் பயன்படுத்துவதற்கும் அறிந்திருந்தார்கள் 18 ஆம் நூற்றாண்டின் தொடக்கத்தில் மணல்மத்தில் (சிலிக்கா – silica) ஒரு வேதித் தனிமம் இருக்கக் கூடும் என்று நம்பினார்கள். சர் ஹம்பிரி டேவி, மின்சாரத்தின் மூலம் மணல்மத்தைப் பகுக்க முயற்சி செய்தார். இந்த வழிமுறையால் பல கார உலோகங்கள் இனமறியப்பட்டன என்றாலும் மணல்மத்தில் இது பயன் தரவில்லை. சிலிகான் ஆக்சைடை பழுக்கக் காய்ச்சி, அதன் மீது உலோகப் பொட்டாசிய ஆவியை பீய்ச்சிச் செய்த முயற்சியும் பலிக்கவில்லை. 1811-ல் கே லூசாக் (L. J. Gay Lussac) மற்றும் தெனார்டு (L. Thenard) ஆகியோர் சிலிகான் டெட்ரா புளுரைடு மற்றும் உலோகப் பொட்டாசியம் இவற்றிற்கிடையே தீவிரமான வேதி வினையை ஏற்படுத்தி செம்பழுப்பு நிறத்தில் ஒரு விளைபொருளைப் பெற்றனர். அதில் படிக உருவற்ற மண்ணியம்(சிலிகான்) இருப்பதாகத் தெரிவித்தனர். 1823 ல் சுவீடன் நாட்டு வேதியியலாரான பெர்சிலியஸ் (J. Berzelius) சிலிகான் ஆக்சைடு (மண்), இரும்பு மற்றும் கரித்தூள் இவற்றைக் கலந்து உயர் வெப்ப நிலைக்குச் சூடுபடுத்தி, இரும்பும் சிலிகானும் சேர்ந்த ஒரு கலப்பு உலோகத்தைப் பெற்றார். பின்னர் கே லூசாக் மற்றும் தென்னார்டின் வழிமுறையைப் பின்பற்றி பழுப்புநிறப் பொருளைப் பெற்றார். நீரோடு செயல்படச் செய்து ஹைட்ரஜன் குமிழ்களை வெளியேற்றி, படிக உருவற்ற மண்ணியத்தை கரும்பழுப்பு நிறத்தில் நீரில் கரையாத ஒரு விளை பொருளாகப் பெற்றார். இதில் பொட்டாசியம் சிலிகோ புளுரைடு வேற்றுப் பொருளாக இருந்தது. இதை மீண்டும் மீண்டும் நீரில் கழுவித் தூய்மைப்படுத்தி தூய மண்ணியத்தைப் பெற்றார். டிவில்லி (de Villi), 1854 ல் படிக உருவ சிலிகானை உருவாக்கிக் காட்டினார்.[10][11]
வணிக ரீதியில் சிலிகாவையும் கார்பனையும் மின்னுலையில், கார்பன் மின் வாய்களின் துணை கொண்டு சூடுபடுத்தி உற்பத்தி செய்கின்றார்கள்.[12][13] This method, known as early as 1854[14] இலத்தீன் மொழிச் சொல்லான சிலிசியம்(Silicium) என்பதிலிருந்தே சிலிக்கான் என்ற பெயர் வந்தது. இது கடினமிக்க கல் என்ற பொருள்படும் சிலக்ஸ் (Silex) என்ற சொல்லிலிருந்து உருவானது.[15][16]
பண்புகள்
தொகுஇயற்பியல் பண்புகள்
தொகுஅறை வெப்பநிலையில் ஒப்பீட்டளவில் சிலிக்கானின் உருகு நிலை மற்றும் கொதிநிலை முறையே சுமார் 1,400 மற்றும் 2,800 டிகிரி செல்சியஸ் ஆகும்.[17] சிலிகான் சூரியன் மற்றும் பல விண்மீன்களில் காணப்படுகிறது. எரோலைட் (aerolites) போன்ற எரிகற்களில் ஒரு முக்கியச் சேர்மானப் பொருளாக உள்ளது. படிக உருவற்ற சிலிகான் பழுப்பு நிறப் பொடியாக இருக்கிறது. இதை உருக்கி ஆவியாக்க முடியும். படிக உருக்கொண்ட சிலிகான் உலோகப் பொலிவும் சாம்பல் நிறமும் கொண்டது.[18] சிலிகானை ஒற்றைப் படிகமாக, படிக வளர்ச்சி முறைகள் மூலம் பெறுகின்றார்கள். ஹைட்ரஜன் வளிம வெளியில் தூய ட்ரை குளோரோசிலேனை வெப்பப் பகுப்பிற்கு உள்ளாக்கி மிகவும் தூய்மையான சிலிகான் படிகத்தைப் பெறுகின்றார்கள். இது குறைக் கடத்தியாலான சாதனங்களின் உற்பத்திக்கு முக்கியமான மூலப் பொருளாக விளங்குகிறது.[19][20] தூய சிலிகான் உள்ளியல்பான அல்லது அகவியல்பான (Intrinsic) குறைக் கடத்தியாகும். இதன் கடத்து திறனை ஒரு சில குறிப்பிட்ட வேற்றுப் பொருட்களை உட்புகுத்தி புறக் காரணியொன்றால் கட்டுப்படுத்த முடியுமாறு மாற்றிக் கொள்ள முடியும். அப்படிப் பெறப்பட்ட குறைக்கடத்தியை "புறவியல்பான குறைக்கடத்தி" (extrinsic) என்பர்.
வேதியல் பண்புகள்
தொகுசிலிகானின் பிணைதிறன் 4. எனவே ஒவ்வொரு சிலிகான் அணுவும் புறச் சுற்றுப் பாதையில் நான்கு எலெக்ட்ரான்களைக் கொண்டிருப்பதால் அருகாமையில் உள்ள நான்கு சிலிகான் அணுக்களுடன் பிணைந்து இணைகின்றன. இதில் 5 பிணை திறன் கொண்ட பாஸ்பரஸ், ஆர்செனிக், ஆண்டிமோனி, பிஸ்மத் போன்ற தனிமங்களில் ஏதாவதொன்றைச் சேர்க்க அதில் கட்டற்ற எலெக்ட்ரான்களின் எண்ணிக்கை அதிகரிக்கின்றது. அதனால் இதை 'எதிர்மின் வகைக் குறைக்கடத்தி' (N-type semiconductor) என்பர் 3 பிணை திறன் கொண்ட போரான், அலுமினியம், காலியம், இண்டியம், தாலியம் இவற்றைச் சேர்க்க அதில் கட்டற்ற நேர் மின் துளைகளின் எண்ணிக்கை அதிகரிக்கின்றது. அதனால் இதை 'நேர் மின் வகைக் குறைக் கடத்தி' (P-type semiconductor) என்பர். இன்றைக்கு குறைக் கடத்தி மின்னணுவியல் துறையில் வியத்தகு மாற்றங்கள் செய்து வருகிறது. அலை பெருக்கி (amplifier), அலையியற்றி (Oscillator) அலைப்பண்பேற்றி (Modulator), அலைப்பண்பிறக்கி (detector), அலைபரப்பி (transmitter), அலைத்திருத்தி (rectifier), வானொலி, தொலைகாட்சி, கைபேசி போன்ற சாதனங்களால் தொழில், போக்குவரத்து, செய்திப் பரிமாற்றம், விண்வெளி ஆய்வு போன்ற பல துறைகள் வளர்ச்சி அடைந்துள்ளன.
சூரிய ஆற்றலை மின்னாற்றலாக மாற்றி ஆற்றல் தேவைகளைப் பூர்த்தி செய்வதற்கு சூரிய மின் சில்லுகளை குறைக் கடத்திகளைக் கொண்டு உற்பத்தி செய்துள்ளனர். சிலிகான் ஓரளவு மந்தமாக வினைபுரியக் கூடியது எனினும் இது ஹாலஜன்களாலும் நீர்த்த காரங்களினாலும் பாதிக்கப் படக்கூடியது[8]. ஹைட்ரோ புளூரிக் அமிலம் தவிர்த்த பிற அமிலங்கள் சிலிகானைப் பாதிப்பதில்லை.
பயன்கள்
தொகுசிலிகான் குறைக் கடத்தியாலான மின்னணுவியல் சாதனங்களை உற்பத்தி செய்யப் பயன்படுகிறது. சிலிகான் தரும் மற்றொரு உற்பத்திப் பொருள் சிலிகோன்களாகும். இதன் பொதுவான வேதிக் குறியீடு R2SiO ஆகும். இதில் R என்பது ஹைட்ரோ கார்பன்களால் ஆன பகுதி மூலக்கூறைக் குறிக்கும். பல்மயமாக்கப் பட்ட பல்ம (polymer) சிலிகோன்களை (R2SiO)n என்று குறிப்பிடுவர். சிலிகோன் குடும்பத்தில் இன்றைக்கு நூற்றுக்கணக்கான சிலிகோன்களைக் கண்டறிந்து பயன்படுத்தி வருகின்றார்கள்.[21] இவை நீர்த்த நீர்மத்திலிருந்து பாகு போன்ற பாய்மங்கள் பசை போன்ற மசகு, மென்மையான திண்மம் போன்ற கூழ்மம்(Colloid), ரப்பர் போன்ற நெகிழ்மம், பிசின்கள் என நீண்ட நெடுக்கைக்கு உட்பட்டிருக்கிறது.[22] இவற்றின் தனிச்சிறப்புகளினால், வழக்கமாகப் பயன்படுத்தப் பட்டு வந்த பல கனிம மற்றும் கரிம வேதிப் பொருட்களுக்கு மாற்றுப் பொருளாக இவை பயன்படுத்தப்படுகின்றன.
பொதுவாக சிலிகோன்கள் தேய்ந்து மெலிவதில்லை. தீவிரமான பருவ மாற்றங்களைத் தாக்குப் பிடிக்கின்றது. நீரை விலக்கித் தள்ளுவதால் நீர் ஒட்டுவதில்லை. செயற்கைக் கோள், போக்குவரத்து ஊர்திகளுக்கான உடல் பாகங்கள், மருத்துவக் கருவிகள்,[23] மின்னேமம் (electrical insulator) ஒட்டு நாடாக்கள், ஒலி மற்றும் ஒளிப் பதிவு நாடாக்கள், வண்ணப் பூச்சு, மெருகூட்டு எண்ணெய்கள், அடைப்பு வளையங்கள் (gasket), தரை விரிப்புகள், குடைத் துணிகள், தார்ப்பாய்கள் என சிலிக்கோன்கள் பயன்படும் துறைகள் விரிவடைந்து கொண்டே வருகின்றன.
சிலிகோன்கள் பொதுவாக அகச் சிவப்புக் கதிர்களின் பெரும்பகுதியை 95 விழுக்காடு வரை கடந்து செல்ல அனுமதிக்கின்றன. அதனால் இவை அகச் சிவப்புக் கதிர்களை ஆராயும் கருவிகளில் பயன்படுகின்றன. மணல் மற்றும் களிமண் வடிவில் சிலிகோன், செங்கல் தயாரிக்கப் பயன்படுகின்றது. இது கட்டுமானப் பொருளாகவும், [24] வெப்ப உலைகளின் உட்சுவருக்கு உகந்த பொருளாகவும் பயன்தருகிறது. சிலிகேட்டுகள் மட்பாண்டங்கள், எனாமல் உற்பத்தி முறையிலும், சிலிகா கண்ணாடி உற்பத்தி முறையிலும் பயன்படுகின்றன[25]. எளிதாகக் கிடைக்கின்ற, விலை மலிவான கண்ணாடியின் இயந்திர, ஒளியியல், வெப்பவியல் மற்றும் மின்னியல் பண்புகள் மிகவும் ஏற்புடையதாய் இருக்கின்றன. ஜன்னல் கதவுகள், விளக்குகள், குப்பிகள், மின்கடத்தாப் பொருள் எனக் கண்ணாடி பல பயன்களைத் தருகின்றது. சிலிகான் கார்பைடு மிகவும் கடினத் தன்மை மிக்க ஒரு பொருள். இது தேய்ப்புப் பொருளாகப் பயன்படுகிறது. லேசர் கருவிகளில் 4560 A ஓரியல் (Monocromatic) ஒளியை ஏற்படுத்த இது பயன்படுத்திக் கொள்ளப்படுகின்றது.
பலவிதமான தோற்றங்களில் சிலிக்கான்
தொகு-
எதிரொளிப்பு தெரியும் சிலிக்கான் சில்லு (NASA)
-
சிலிக்கான் துகள்
-
நேனோ படிக சிலிக்கான் துகள்
மேற்கோள்களும் குறிப்புகளும்
தொகு- ↑ Weeks, Mary Elvira (1932). "The discovery of the elements: XII. Other elements isolated with the aid of potassium and sodium: beryllium, boron, silicon, and aluminum". Journal of Chemical Education: 1386–1412.
- ↑ Voronkov, M. G. (2007). "Silicon era". Russian Journal of Applied Chemistry 80 (12): 2190. doi:10.1134/S1070427207120397.
- ↑ Ram, R. S. et al. (1998). "Fourier Transform Emission Spectroscopy of the A2D–X2P Transition of SiH and SiD". J. Mol. Spectr. 190: 341–352. பப்மெட்:9668026. http://bernath.uwaterloo.ca/media/184.pdf.
- ↑ Magnetic susceptibility of the elements and inorganic compounds, in Lide, D. R., ed. (2005). CRC Handbook of Chemistry and Physics (86th ed.). Boca Raton (FL): CRC Press. பன்னாட்டுத் தரப்புத்தக எண் 0-8493-0486-5.
- ↑ Physical Properties of Silicon. New Semiconductor Materials. Characteristics and Properties. Ioffe Institute
- ↑ 6.0 6.1 6.2 6.3 [1] Hopcroft, et al., "What is the Young's Modulus of Silicon?" IEEE Journal of Microelectromechanical Systems, 2010
- ↑ Geological Survey (U.S.) (1975). Geological Survey professional paper.
- ↑ 8.0 8.1 Greenwood 1997, ப. 342.
- ↑ Nave, R. Abundances of the Elements in the Earth's Crust, Georgia State University
- ↑ Silicon: History பரணிடப்பட்டது 2011-07-27 at the வந்தவழி இயந்திரம். Nautilus.fis.uc.pt. Retrieved on 2011-08-07.
- ↑ Information on silicon – history, thermodynamic, chemical, physical and electronic properties: Etacude.com. Elements.etacude.com. Retrieved on 2011-08-07.
- ↑ Rao, Gopalakrishna M. (1980). "Electrowinning of Silicon from K2SiF6-Molten Fluoride Systems". Journal of the Electrochemical Society 127 (9): 1940. doi:10.1149/1.2130041. https://archive.org/details/sim_journal-of-the-electrochemical-society_1980-09_127_9/page/1940.
- ↑ De Mattei, Robert C. (1981). "Electrodeposition of Silicon at Temperatures above Its Melting Point". Journal of the Electrochemical Society 128 (8): 1712. doi:10.1149/1.2127716. https://archive.org/details/sim_journal-of-the-electrochemical-society_1981-08_128_8/page/1712.
- ↑ Deville, H. St. C. (1854). "Recherches sur les métaux, et en particulier sur l'aluminium et sur une nouvelle forme du silicium". Ann. Chim. Phys. 43: 31. http://gallica.bnf.fr/ark:/12148/bpt6k34784b.image.f31.langFR.
- ↑ Weeks, Mary Elvira (1932). "The discovery of the elements: XII. Other elements isolated with the aid of potassium and sodium: beryllium, boron, silicon, and aluminum". Journal of Chemical Education: 1386–1412.
- ↑ Voronkov, M. G. (2007). "Silicon era". Russian Journal of Applied Chemistry 80 (12): 2190. doi:10.1134/S1070427207120397.
- ↑ Gray, Theodore (2009). The ELements: A Visual Exploration of Every Known Atom in the Universe. Black Dog and Leventhal Publishers. p. 43. பன்னாட்டுத் தரப்புத்தக எண் 978-1-57912-814-2.
- ↑ O'Mara, William C. (1990). Handbook of Semiconductor Silicon Technology. William Andrew Inc. pp. 349–352. பன்னாட்டுத் தரப்புத்தக எண் 0-8155-1237-6. பார்க்கப்பட்ட நாள் 2008-02-24.
- ↑ Semiconductors Without the Quantum Physics. Electropaedia
- ↑ Hull, Robert (1999). Properties of crystalline silicon. p. 421. பன்னாட்டுத் தரப்புத்தக எண்:978-0-85296-933-5. http://books.google.com/books?id=C_TWB_0rRLgC&pg=PA421.
- ↑ NNDC contributors (2008). Alejandro A. Sonzogni (Database Manager) (ed.). "Chart of Nuclides". Upton (NY): National Nuclear Data Center, Brookhaven National Laboratory. Archived from the original on 2018-10-10. பார்க்கப்பட்ட நாள் 2008-09-13.
{{cite web}}:|author=has generic name (help) - ↑ Lickiss, Paul D. (1994). Inorganic Compounds of Silicon, in Encyclopedia of Inorganic Chemistry. John Wiley & Sons. pp. 3770–3805. பன்னாட்டுத் தரப்புத்தக எண் 0-471-93620-0.
- ↑ Jerschow, Alexej. "Interactive NMR Frequency Map". New York University. பார்க்கப்பட்ட நாள் 2011-10-20.
- ↑ Greenwood 1997, ப. 356.
- ↑ Koch, E.C.; Clement, D. (2007). "Special Materials in Pyrotechnics: VI. Silicon – An Old Fuel with New Perspectives". Propellants, Explosives, Pyrotechnics 32 (3): 205. doi:10.1002/prep.200700021. http://www3.interscience.wiley.com/cgi-bin/abstract/114279686/ABSTRACT.[தொடர்பிழந்த இணைப்பு]