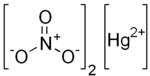
பாதரச(II) நைட்ரேட்டு
பாதரச (II) நைட்ரேட்டு (Mercury(II) nitrate) என்பது நைட்ரிக் அமிலத்தின் நிறமற்ற அல்லது வெண்மை நிறமுடைய கரையக்கூடிய படிக பாதரச (II) உப்பு ஆகும். இது நச்சுத் தன்மையுடைய உப்பு ஆகும். ' கேரட்டிங் ' என்று அழைக்கப்படும் ஒரு செயல்பாட்டில் ரோமங்களுக்கு சிகிச்சையளிக்க இது பயன்படுத்தப்பட்டது. ஆங்கிலத்தில் மேட் அசு ஏட்டர் என்று அழைக்கப்படக் கூடிய பித்து நிலைக்கு பாதரசம் (II) நைட்ரேட்டு உடலின்மீது அதிகமாக வெளிப்படுத்தப்படுவது ஒரு காரணமாக அமைகிறது. 1941 டிசம்பரில் அமெரிக்காவின் பொது சுகாதார சேவையால் தடைசெய்யப்படும் வரை இந்த சிகிச்சைகள் அமெரிக்காவில் தொடர்ந்தன. இந்த தடை ஆரோக்கியத்திற்கு நன்மை பயக்கும் என்று தோன்றினாலும், தடையானது உண்மையில் பாதரச(II) நைட்ரேட்டை அன்றைய போரில் டெட்டனேட்டர்கள் தயாரிப்பில் பயன்படுத்துவதிலிருந்து விடுவித்தது.[1]
| |
| பெயர்கள் | |
|---|---|
| ஐயூபிஏசி பெயர்s
பாதரச டைநைட்ரேட்டு
பாதரச(II) நைட்ரேட்டு | |
| வேறு பெயர்கள்
மெர்குரிக் நைட்ரேட்டு
| |
| இனங்காட்டிகள் | |
| 10045-94-0 7783-34-8 (monohydrate) | |
| ChemSpider | 23247 |
| EC number | 233-152-3 |
InChI
| |
| யேமல் -3D படிமங்கள் | Image |
| பப்கெம் | 16683796 |
| வே.ந.வி.ப எண் | OW8225000 |
| |
| UNII | 2FMV9338BW |
| UN number | 1625 |
| பண்புகள் | |
| Hg(NO3)2 | |
| வாய்ப்பாட்டு எடை | 324.60 கி/மோல் (நீரற்ற சேர்மம்) |
| தோற்றம் | நிறமற்ற படிகங்கள் அல்லது வெண்ணிறத் தூள் |
| மணம் | நுண்ணிய மணம் |
| அடர்த்தி | 4.3 கி/செமீ3 (ஒற்றைஐதரேட்டு) |
| உருகுநிலை | 79 °C (174 °F; 352 K) (ஒற்றைஐதரேட்டு) |
| கரையக்கூடியது | |
| கரைதிறன் | நைட்ரிக் காடி, அசிட்டோன், அமோனியா ஆகியவற்றில் கரையும் எத்தனாலில் கரையாது |
| −74.0·10−6 செமீ3/மோல் | |
| தீங்குகள் | |
| பொருள் பாதுகாப்பு குறிப்பு தாள் | ICSC 0980 |
| ஈயூ வகைப்பாடு | மிகுந்த நச்சுத்தன்மை வாய்ந்தது (T+) சுற்றுச்சூழலுக்கு ஆபத்து நிறைந்தது (N) |
| R-சொற்றொடர்கள் | R26/27/28, R33, R50/53 |
| S-சொற்றொடர்கள் | (S1/2), S13, S28, S45, S60, S61 |
| தீப்பற்றும் வெப்பநிலை | எளிதில் தீப்பற்றாதது |
| தொடர்புடைய சேர்மங்கள் | |
| ஏனைய எதிர் மின்னயனிகள் | பாதரச(II) சல்பேட்டு பாதரச(II) குளோரைடு |
| ஏனைய நேர் மின்அயனிகள் | துத்தநாக நைட்ரேட்டு காட்மியம் நைட்ரேட்டு |
மாறுதலாக ஏதும் சொல்லவில்லை என்றால் கொடுக்கப்பட்ட தரவுகள் யாவும் பொருள்கள் அவைகளின் இயல்பான வெப்ப அழுத்த நிலையில் (25°C, 100kPa) இருக்கும். | |
தயாரிப்பு
தொகுபாதரச(II) நைட்ரேட்டானது, பாதரச உலோகத்துடன் சூடான, செறிவூட்டப்பட்ட நைட்ரிக் அமிலத்தை வினைபுரியச் செய்வதன் மூலம் தயாரிக்கப்படுகிறது. இந்த நிலைமைகளின் கீழ், நைட்ரிக் அமிலம் ஓர் ஆக்சிசனேற்றியாகும். நீர்த்த நைட்ரிக் அமிலத்துடனான வினை பாதரச (I) நைட்ரேட்டை உருவாக்கும்.
பயன்கள்
தொகுபாதரச(II) நைட்ரேட்டு பாதரசமாக்கல் வினைகளில் பயன்படுத்தப்படுகிறது. குறிப்பாக, கீட்டோன்கள் சம்பந்தப்பட்ட வினைகளில் இது பயன்படுத்தப்படுகிறது. அசிட்டோனுடன் வினைபுரிகையில் இது மிகவும் திறன் வாய்ந்ததாகும். இந்த வினையானது பாதரச(II) நைட்ரேட்டு, பாதரச(II) ஆக்சைடு மற்றும் கால்சியம் சல்பேட் ஆகியவற்றைப் பயன்படுத்தி அசிட்டோனை (CH3C(O)CH3)மாற்றும், CH3C(O)CH2Hg ஆக மாற்றுகிறது. மற்ற பிற இரசஞ்சேர்த்தல் செயல்முறைகளுக்கு அசிட்டோன் திறனற்றதாக உள்ளது. பாதரச(II) நைட்ரேட் சேர்மம் ஒரு வலிமையான ஆக்சிசனேற்றியாக இருப்பதால் செயல்படுகிறது.[2] கூடுதலாக, நைட்ரிக் அமிலத்தில் பாதரசம் கரைக்கப்படும் போது பாதரச நைட்ரேட்டின் அமில வடிவமானது உருவாகிறது. அமில வடிவம் சுக்ரோசின் மூலக்கூறுகளைத் தலைகீழாக மாற்றும் திறன் கொண்டது.
உடல்நலம் சார்ந்த தகவல்கள்
தொகுபாதரச(II) நைட்ரேட்டு உடலை Hg 2+ ஆக இருந்து பாதிக்கிறது. இது கனிம பாதரசத்தின் ஒரு வடிவமாகக் கருதப்படுகிறது. கனிம பாதரசத்தின் வடிவங்களானவை தோலை ஒளிரச் செய்யும் களிம்புகள் உள்ளிட்ட பல்வேறு சூழல்களில் காணலாம். கனிம பாதரசம் உட்கொள்ளப்பட்டால் அது உடலுக்குள் முக்கியமான புரதங்களின் கட்டமைப்பை மாற்றும். மண்ணில் இறங்கினால் அது தாவரங்களால் உறிஞ்சி எடுத்துக்கொள்ளப்பட முடியும்.[3] பாதரச நச்சால் பாதிக்கப்பட்டவர்கள் மார்பில் வலி, இருமல் மற்றும் சுவாசிப்பதில் சிரமம், வாந்தியெடுத்தல் மற்றும் வயிற்றுப்போக்கு ஆகியவற்றை அவர்களின் ஆரம்ப அறிகுறிகளாக அனுபவிக்கிறார்கள். கண்ணில் பட்டால் கண் வெளிப்படலம் மற்றும் கருவிழி ஆகியவற்றில் புண்ணை ஏற்படுத்தக்கூடும்.[2]
வினையில் ஈடுபடும் திறன்
தொகுபாதரச(II) நைட்ரேட் எரியக்கூடிய சேர்மமாக இல்லை என்றாலும், அது ஆக்சிசனேற்றியாக செயல்படுவதால் தீப்பிழம்புகளை விரைவுபடுத்தும். கூடுதலாக, இது ஆல்ககால்களுடன் இணைந்தால் வெடிக்கும் சேர்மங்களை உருவாக்கலாம்.[4]
பாதுகாப்பு நடவடிக்கைககள்
தொகுஉடனடி முன்னெச்சரிக்கை நடவடிக்கையாக, திரவங்களுக்கு குறைந்தபட்சம் 50 மீட்டர் (150 அடி) மற்றும் திடப்பொருட்களுக்கு குறைந்தபட்சம் 25 மீட்டர் (75 அடி) வரை அனைத்து திசைகளிலும் கசிவு அல்லது கசிவு பகுதியை தனிமைப்படுத்தவும். சிறிய அளவிலான தீயைக் கட்டுப்படுத்த தண்ணீரைப் பயன்படுத்தலாம். உலர் வேதிப்பொருட்கள் அல்லது நுரை வகை தீயணைப்பான்களைப் பயன்படுத்த வேண்டாம். கார்பனீராக்சைடு வகை தீயணைப்பான்கள் வரையறுக்கப்பட்ட கட்டுப்பாட்டை வழங்கக்கூடும்.[4]
மேற்கோள்கள்
தொகு- ↑ "The Not-So-Mad Hatter: Occupational Hazards of Mercury". Archived from the original on 2018-06-19. பார்க்கப்பட்ட நாள் 2019-12-25.
- ↑ 2.0 2.1 "Mercuric Nitrate".
- ↑ "Elemental Mercury and Inorganic Mercury Compounds:Human Health Aspects" (PDF).
- ↑ 4.0 4.1 "Mercuric Nitrate".
புற இணைப்புகள்
தொகு- ATSDR - Toxic Substances Portal - Mercury (11/14/2013)
- ATSDR - Public Health Statement: Mercury (11/14/2013)
- ATSDR - ALERT! Patterns of Metallic Mercury Exposure, 6/26/97 (link not traceable 11/14/2013)
- ATSDR - Medical Management Guidelines for Mercury (11/14/2013)
- ATSDR - Toxicological Profile: Mercury (11/14/2013)
- Safety data (MSDS)[தொடர்பிழந்த இணைப்பு] (link not traceable 11/14/2013)
- Mercuric Nitrate (ICSC)
- Mercury பரணிடப்பட்டது 2018-02-17 at the வந்தவழி இயந்திரம்
- Mercury Information Packages
- How to Make Good Mercury Electrical Connections, Popular Science monthly, February 1919, Unnumbered page, Scanned by Google Books: https://books.google.com/books?id=7igDAAAAMBAJ&pg=PT14
| HNO3 | He | ||||||||||||||||
| LiNO3 | Be(NO3)2 | B(NO 3)− 4 |
RONO2 | NO− 3 NH4NO3 |
HOONO2 | FNO3 | Ne | ||||||||||
| NaNO3 | Mg(NO3)2 | Al(NO3)3 | Si | P | S | ClONO2 | Ar | ||||||||||
| KNO3 | Ca(NO3)2 | Sc(NO3)3 | Ti(NO3)4 | VO(NO3)3 | Cr(NO3)3 | Mn(NO3)2 | Fe(NO3)2 Fe(NO3)3 |
Co(NO3)2 Co(NO3)3 |
Ni(NO3)2 | CuNO3 Cu(NO3)2 |
Zn(NO3)2 | Ga(NO3)3 | Ge | As | Se | BrNO3 | Kr |
| RbNO3 | Sr(NO3)2 | Y(NO3)3 | Zr(NO3)4 | Nb | Mo | Tc | Ru(NO3)3 | Rh(NO3)3 | Pd(NO3)2 Pd(NO3)4 |
AgNO3 Ag(NO3)2 |
Cd(NO3)2 | In(NO3)3 | Sn(NO3)4 | Sb(NO3)3 | Te | INO3 | Xe(NO3)2 |
| CsNO3 | Ba(NO3)2 | Hf(NO3)4 | Ta | W | Re | Os | Ir | Pt(NO3)2 Pt(NO3)4 |
Au(NO3)3 | Hg2(NO3)2 Hg(NO3)2 |
TlNO3 Tl(NO3)3 |
Pb(NO3)2 | Bi(NO3)3 BiO(NO3) |
Po(NO3)4 | At | Rn | |
| FrNO3 | Ra(NO3)2 | Rf | Db | Sg | Bh | Hs | Mt | Ds | Rg | Cn | Nh | Fl | Mc | Lv | Ts | Og | |
| ↓ | |||||||||||||||||
| La(NO3)3 | Ce(NO3)3 Ce(NO3)4 |
Pr(NO3)3 | Nd(NO3)3 | Pm(NO3)3 | Sm(NO3)3 | Eu(NO3)3 | Gd(NO3)3 | Tb(NO3)3 | Dy(NO3)3 | Ho(NO3)3 | Er(NO3)3 | Tm(NO3)3 | Yb(NO3)3 | Lu(NO3)3 | |||
| Ac(NO3)3 | Th(NO3)4 | PaO2(NO3)3 | UO2(NO3)2 | Np(NO3)4 | Pu(NO3)4 | Am(NO3)3 | Cm(NO3)3 | Bk(NO3)3 | Cf | Es | Fm | Md | No | Lr | |||